
Las 10 principales reglas de la titulación (parte 1-Preparación de la muestra)
Ya sea que esté titulando con una bureta manual y un indicador de color, o utilizando un sistema de titulación automática, existen 10 reglas principales que los científicos exitosos realizan. Estás 10 reglas se dividen en cuatro categorías: preparación de la muestra, análisis, revisión de los resultados y mantenimiento.
¿Qué es la titulación? ¿Por qué automatizarla?
La titulación es una técnica analítica que se utiliza para cuantificar un gran número de productos químicos en diferentes industrias. La titulación manual puede ser inexacta y los resultados pueden variar entre cada operador según la subjetividad de los indicadores de color. Invertir en un sistema de titulación automática como el HI932 de Hanna Instruments, es un paso para mejorar en gran medida la exactitud y repetibilidad de los resultados de la titulación. Sin embargo, el instrumento por sí mismo es solo una parte del rompecabezas de la exactitud. El pensamiento crítico y la aplicación de las mejores prácticas a través de todo el proceso de análisis de las muestras mejorarán aún más la exactitud cuanto se utiliza un sistema automatizado. Este artículo sirve como una guía general para maximizar la exactitud de los resultados de titulación cubriendo las mejores prácticas para la preparación de la muestra, análisis, revisión de los resultados y mantenimiento.
Preparación de la muestra
#1 Elegir el tamaño de muestra correcto
Elegir el tamaño correcto de la muestra es uno de los criterios más importantes para garantizar que los resultados de la titulación sean exactos, eficientes y rentables. Utilizar una muestra que es demasiado pequeña puede producir resultados inexactos ya que ofrece poca resolución en términos de información. Cuando la información es limitada, es muy difícil interpolar en donde se encuentra el verdadero punto equivalente. Esto da como resultado poca repetibilidad y exactitud. Por el contrario, el uso de demasiada muestra causará altos costos de productos químicos debido al uso excesivo de titulante, así como un exceso de residuos producidos. El tamaño de muestra ideal debe consumir un volumen de titulante entre el 25-75% del volumen total de la bureta.
Usted podrá pensar, ¿cómo podemos conocer cuánta muestra utilizar para consumir esa cantidad de titulante? Afortunadamente, si conocemos la concentración estimada de la muestra, hay una forma sencilla de determinar el tamaño de la muestra apropiado en función del consumo de titulante utilizando la ecuación de titulación:
CA = VT ∗ CT ∗ RR ∗ MM ∗ FC
TM
Dónde:
CA es la concentración del analito (la que está tratando de medir)
VT es el volumen de titulante utilizado para alcanzar el punto final
CT es la concentración del titulante
RR es la relación de reacción estequiométrica del analito:titulante, en ese orden
MM es la masa molar del analito
FC es el factor de conversión para ajustar los resultados a las unidades de medidas elegidas (si es necesario)
TM es el tamaño de la muestra del analito, y puede ser una masa o un volumen
Se puede reorganizar la ecuación de titulación para resolver el tamaño de la muestra. Con un simple reacomodo, se puede resolver fácilmente para el tamaño de muestra apropiado colocando en la ecuación los valores conocidos.
TM = VT ∗ CT ∗ RR ∗ MM ∗ CF
CA
Veamos un ejemplo del mundo real. La salsa de tomate es un condimento muy popular y uno de los componentes que se le analiza regularmente es el contenido de sal. Para determinar el intervalo de tamaño de muestra apropiado para una titulación del contenido de sal (cloruro de sodio – NaCl) en la salsa de tomate (con un contenido estimado de sal de 2%), usando nitrato de plata 0.1M (mol/L) como titulante y usando una bureta de 25 mL.
Aplicando la regla de 25 – 75% para una bureta de 25 mL (0.025L), idealmente, se debería consumir entre 6 y 19 mL (0.006 – 0.019L) de titulante.
Teniendo la ecuación, se define las variables y se calculan los límites superior e inferior para el tamaño de la muestra.
TM = VT ∗ CT ∗ RR ∗ MM ∗ CF
CA
TM es nuevamente el tamaño de la muestra, en este caso, el valor que necesitamos encontrar.
VT es nuestro volumen de titulante, para el límite inferior, hemos calculado que esto es 0.006L
CT es la concentración del titulante, por lo que para este ejemplo es 0.1M (mol/L)
RR es la relación de reacción del analito, sal (NaCl), para el titulante, nitrato de plata (AgNO3). Esta información se obtiene de la ecuación química balanceada: NaCl+ AgNO3 → AgCl +NaNO3.
Como no hay coeficientes antes de cada titulante o analito, se asume que será 1. Por lo tanto, esta ecuación nos indica que 1 mol de sal consumirá 1 mol de nitrato de plata, haciendo que la proporción sea 1:1, el cual es igual a 1.
MM es la masa molar del analito, cloruro de sodio el cual tiene una masa molar de 58.44 g/mol (gramos por mol)
CA es la concentración del analito el cual se estima que será del 2%, lo que equivale a 2g/100g.
Ahora que se han definido las variables para el límite inferior, se sustituyen en la ecuación:
TM = 0.006L ∗ (0.1 mol ⁄ L) ∗ 1 ∗ (58.44 g ⁄ mol) ∗ 1
(2g ⁄ 100g)
Cancelando las unidades:
TM = 0.006L ∗ (0.1 mol ⁄ L) ∗ 1 ∗ (58.44 g ⁄ mol) ∗ 1
(2g ⁄ 100g)
Resolviendo la ecuación para el TM:
TM = 1.75 g
Sustituyendo el valor límite superior del titulante de 0.019L como el VT en la ecuación, se obtiene como resultado 5.55 gramos.
Por lo tanto, para este ejemplo, ~1.75 – 5.55 gramos del producto es el intervalo de muestra ideal que consumirá suficiente titulante para una buena resolución de la información.
#2 Usar una muestra representativa
El tamaño de la muestra no es la única consideración para trabajar con matrices de muestras complejas. Es crucial estar seguros que se utiliza una muestra representativa para la determinación exacta del analito. Una muestra representativa es una que envuelve la matriz de la muestra como un todo, en el que están contenidas todas las partes del producto o muestra original en las proporciones correctas. Esto es especialmente importante para muestras que no son homogéneas, como mezclas de especias o suelos. Si los resultados no son repetibles, incluso cuando se usa una técnica de medición adecuada, la fuente probable de error está es una muestra no representativa.
Algunas veces es difícil garantizar una muestra representativa en un intervalo de muestra recomendado por el método. Si este es el caso, una dilución es una excelente manera de asegurar una muestra representativa, a la vez que se utiliza un tamaño de muestra adecuado para una buena resolución de la información. Una dilución también es una buena idea si el tamaño de la muestra sugerido en la sección anterior es muy pequeño para medirlo. Con una dilución, se pesa una mayor cantidad de muestra y se agrega a un matraz volumétrico. Se agrega agua desionizada al matraz para llevar el contenido al volumen deseado. La mezcla se agita durante un periodo de tiempo hasta homogenizarlo y/o extraer el analito. Una pequeña alícuota de esta mezcla se titula hasta el punto final. Con el sistema de titulación automática de Hanna Instruments, el usuario puede programar la dilución en el titulador, y los resultados se ajustarán por el factor de dilución.
Para programar una dilución en el titulador, se necesitará:
Tamaño del analito a diluir (tamaño de la muestra): La masa o el volumen del material agregado al matraz volumétrico.
Volumen final: El volumen una vez que se ha agregado el agua desionizada a la muestra.
Tamaño de la alícuota: El volumen de la muestra que se usará para la titulación.
#3 Uso de las técnicas y herramientas de medición adecuadas
Utilizar las técnicas y herramientas de medición adecuadas son componentes cruciales en la estrategia para mejorar la exactitud de los resultados de la titulación. Recuerde de nuestra ecuación de titulación que el tamaño de la muestra es un factor directo en los resultados.
Si el tamaño de la muestra que se ingresa en el titulador es inexacto, el resultado de la titulación será igual de inexacto. Por lo tanto, es importante asegurarse de que puede obtener alícuotas de muestras con las herramientas apropiadas. Típicamente, las muestras líquidas son medidas en volumen y las muestras sólidas se miden en masa.
Muestras líquidas
Comenzaremos hablando acerca del manejo de líquidos. No todo el material de vidrio volumétrico ha sido fabricado por igual, por lo que es importante comprender los diferentes tipos de materiales de vidrio y sus propósitos.
Vasos y matraces Erlenmeyer

Los vasos de precipitados y los matraces Erlenmeyer, a pesar de que contienen marcas graduadas para indicar el volumen de la muestra, se usan principalmente para almacenar, verter o mezclar soluciones. Por lo general, no están graduados con exactitud para mediciones de volúmenes específicas. El uso de herramientas como estas para medir el tamaño de una muestra podría causar fluctuaciones en los resultados, lo que dificulta la repetibilidad de sus pruebas.
Pipetas de transferencia

Las pipetas de transferencia desechables (que no deben confundirse con las pipetas volumétricas desechables) son otra herramienta que puede parecer exactas debido a sus marcas, pero generalmente no están calificados para su exactitud. No son herramientas recomendadas para mediciones volumétricas, pero son excelentes herramientas para la adición de reactivos que no requieren una adición precisa.
Probetas graduadas.
Las probetas graduadas están diseñadas para medir y verter líquidos. Generalmente tienen una tolerancia de error del 1% y se consideran menos exactas que los matraces y las pipetas volumétricas. Son rápidos y fáciles de usar, y pueden ser una buena opción para entornos de altos rendimientos.
Matraces volumétricos

Los matraces volumétricos son exactos para un volumen específico de líquido. No tienen marcas graduadas para medir diferentes volúmenes de solución, pero son el material de vidrio de elección para realizar diluciones exactas.
Pipetas volumétricas
Las pipetas volumétricas suelen ofrecer la mayor exactitud y son ideales para transferir líquidos de una fuente a otra. Este tipo de pipeta incluye pipetas de plástico desechables, pipetas de vidrio y pipetas automáticas. Para lograr la exactitud usando estas herramientas, es muy importante que se utilice una técnica adecuada al tomar la muestra. Los dos factores más importantes son el ángulo de aspiración y la profundidad de inmersión. Cuando se recolecta una muestra con una pipeta, la pipeta debe mantenerse verticalmente para asegurar que se aspire la cantidad adecuada de líquido. La pipeta solo debe sumergirse en la muestra lo suficiente como para poder aspirar la cantidad deseada sin extraer aire. Además, la muestra se debe aspirar y dispensar varias veces para cebar la punta de la bureta antes de transferir una alícuota final de muestra al vaso de titulación. Cuando se dispensa líquido de una pipeta, la pipeta debe colocarse en un ángulo entre 20 – 45 grados directamente en el centro del vaso. Se debe tener cuidado de no expulsar a la fuerza cualquier remanente de líquido de la pipeta.
Mejores prácticas para el manejo de líquidos
Incluso entre el mismo tipo de material de vidrio, hay una clase de sistemas para cuantificar la exactitud. El material de vidrio clase A es el más exacto, y generalmente cuenta con una exactitud de dos decimales. Esta clase de vidrio generalmente vendrá con un certificado que especifica su exactitud. El material de vidrio clase B tiene una mayor tolerancia al error que la clase A y cuenta con un decimal de exactitud. Como tal, el material de vidrio clase A tiende a ser más costoso que el de Clase B. Para las necesidades de alta exactitud, se recomienda el material de vidrio clase A y vale la pena la inversión. También es útil utilizar material volumétrico que está orientado al tamaño de la muestra que se mide. Medir 10 mL de muestra en una probeta graduada de 10 mL será más exacto que medir 10 mL con una probeta graduada de 100 mL.
Para lograr exactitud en las mediciones volumétricas, es importante asegurarse de que el volumen se lea correctamente. El agua tiende a curvarse en la parte superior del volumen, haciendo difícil definir la medición. Esta curvatura es llamada menisco. Cuando se lee el volumen en el material volumétrico, la parte inferior del menisco debe estar en la marca del volumen deseado.
Cuando se agrega una muestra líquida a un vaso de precipitados, se debe asegurar de que la muestra se agregue en el centro del vaso y que no toque las paredes. En la mayoría de los casos, se puede usar una pequeña cantidad de agua desionizada para enjuagar cualquier remanente de la muestra en las paredes del contenedor.
El material de vidrio debe enjuagarse con agua desionizada y secarse entre cada muestra, o si se utiliza una pipeta automática, se debe usar una punta nueva para cada muestra diferente. Todo el material de vidrio debe limpiarse con jabón de laboratorio, enjuagarse con ácido (si es necesario) y enjuagarse con agua desionizada antes de almacenarlo.
Algunas muestras líquidas son demasiado viscosas para medirse volumétricamente con exactitud. En este caso, se puede medir por su masa en lugar de volumen. Sin embargo, se debe tener cuidado porque si las unidades finales son referidas al volumen, se debe tener en cuenta la densidad de la muestra en los cálculos de los resultados.
Muestras Sólidas
Al igual que con el manejo de líquidos, es importante utilizar las herramientas y técnicas adecuadas cuando se trabaja con muestras sólidas.
Comprender la diferencia entre báscula y balanza es la clave. Usualmente usamos los términos de báscula y balanza indistintamente, pero existen diferencias claras entre ellas.
Las básculas tienden a poder manejar grandes cantidades de masa (tanto pesadas como ligeras). Se prestan bien para medir ingredientes o productos a granel rápidamente. Las básculas son más económicas que las balanzas. Sin embargo, su diseño abierto y su baja resolución no lo hacen adecuado o ideales para medir tamaños de muestras para titulación. Introducen variabilidad y afecta la repetibilidad de la titulación.
Las balanzas analíticas suelen ser más sofisticadas que las básculas. Además, ofrecen características como escudos para proteger la muestra de corrientes de aire que podrían ocasionar variaciones en los resultados. Las balanzas analíticas también varían ampliamente en términos de precio y resolución, por lo que es importante elegir la balanza analítica correcta para los tamaños de muestras típicas. A continuación, se muestran las resoluciones recomendadas con base en el tamaño de muestra deseado.

| Es recomendable que todas las balanzas se calibren anualmente | |
| Tamaño de la muestra | Resolución de la balanza |
| 1 gramo | 0.1 gramos |
| 0.1 gramos | 0.01 gramos |
| 0.01 gramos | 0.001 gramos |
| 0.001 gramos | 0.0001 gramos |
Mejores prácticas para muestras sólidas
Cuando se configura una balanza analítica, se debe elegir un lugar que se encuentre alejado de puertas, campanas de extracción y ventilaciones para reducir aún más la posibilidad de interferencias. Para ser exactos, las balanzas deben nivelarse apropiadamente y calibrarse de acuerdo con las instrucciones del fabricante. Puede adquirir un conjunto de pesas para garantizar que la balanza está leyendo adecuadamente.
Las balanzas ser deben tarar, o llevarlas a cero, con el recipiente de pesaje antes de agregar la muestra. Para obtener mejores resultados, tome la masa de la muestra directamente en el vaso de titulación asegurándose de no derramar producto sobre la balanza. Si se utiliza un recipiente de pesaje, enjuague el contenido tres veces con agua desionizada para asegurar que todo el producto se tome en cuenta. Dado que el agua desionizada, en la mayoría de los casos, no contiene el analito que será analizado, se puede agregar sin temor a interferencias.
Debe estar familiarizado con la exactitud de sus herramientas de medición, ya que el resultado final de la titulación solo será tan preciso como su variable menos precisa en la titulación
#4 Utilizar el tipo correcto de agua

Al igual que con el material de vidrio, el agua no es igual. Existen diferentes clasificaciones de agua basadas en el proceso de purificación al que se somete. Al preparar las muestras, es importante asegurarse que se tiene y se usa el agua correcta.
Agua potable
El agua potable es el agua que proviene de un pozo privado o de una fuente municipal. Contiene todo tipo de contaminantes, incluyendo minerales y desinfectantes que contribuyen al pH, acidez y alcalinidad. Debido a la presencia de contaminantes potenciales, el agua potable no se recomienda para el análisis de laboratorio sin purificación adicional. El agua potable, típicamente, tiene un nivel de sólidos totales disueltos (TDS) de 100 – 500 partes por millón (ppm)
Osmosis Inversa
La ósmosis inversa, abreviada como agua RO, es agua que ha sido purificado mediante presión forzada a través de una membrana semipermeable. Los contaminantes quedan atrapados en el filtro, mientas que el agua limpia pasa a través de la membrana. El agua de ósmosis inversa elimina el 98% de los sólidos totales disueltos (STD), pero no elimina todos los pesticidas, sólidos o COV’s. El agua RO contiene un STD < 100 ppm.
Agua destilada
El agua destilada, abreviada como DH2O, es agua que ha sido purificada a través del proceso de destilación. Este tipo de agua se hierve y el vapor se condensa en un recipiente de almacenamiento estéril, dejando los contaminantes sólidos. Sin embargo, cualquier compuesto con un punto de ebullición que sea más bajo que el agua, como los compuestos orgánicos volátiles (COV’s), se transferirán en el destilado. El agua embotellada no es lo mismo que el agua destilada, ya que la primera es fortificada con minerales. El agua destilada tiene un valor de STD <0.5 ppm.
Agua desionizada
El agua desionizada, abreviada como DI H2O, está libre de casi todos los contaminantes y es el estándar premium del agua para análisis de laboratorio. Primero, el agua se hace pasar a través de una seria de filtros que incluyen filtrado físico, de carbono y ósmosis inversa. El agua después pasa por resinas aniónicas y catiónicas DI. Aquí, los iones positivos y negativos son capturados y reemplazados con iones H+ y OH–, que se combinan para formar agua pura. El agua desionizada se mide típicamente por medio de la resistividad, y debe tener un valor de al menos 18 MΩ•cm.
Aplicación
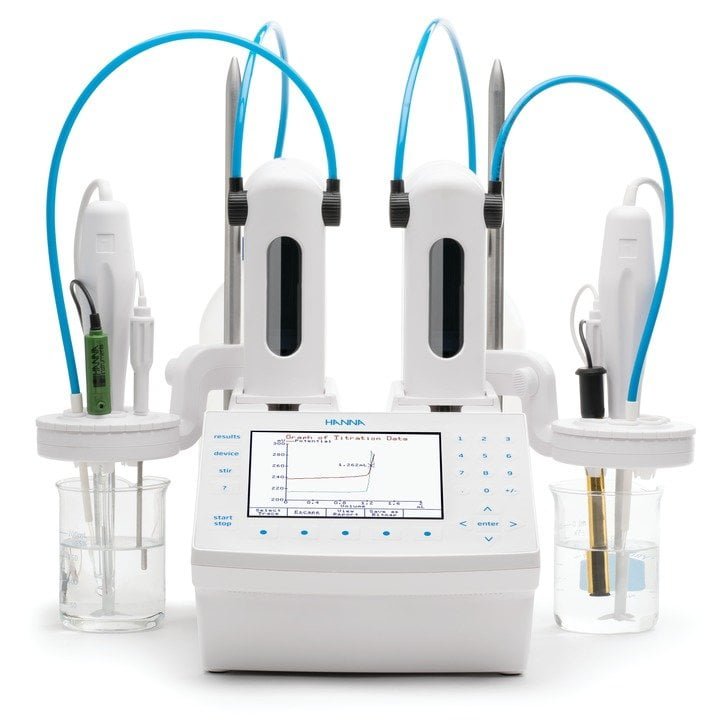
Hanna Instruments cuenta con tituladores automáticos que le ayudarán a realizar sus análisis de una manera más rápida y precisa.
El titulador automático HI932 tiene la capacidad de realizar una gran variedad de mediciones. Con el electrodo adecuado, se pueden realizar titulaciones estándar, titulaciones inversas, además de mediciones de pH, ORP y lecturas de ion selectivo.
Con este equipo el usuario podrá tener un mejor control de la solución de titulación ya que utiliza una bureta que aspira y dosifica el líquido de manera automática, el punto final de la titulación se realiza a través de sensores que detectan la cantidad de analito presente en una muestra, sin necesidad de utilizar indicadores de color que pueden dar resultados poco exactos y baja repetibilidad.
A continuación, se mencionan las especificaciones del titulador automático HI932
| Intervalo de pH | -2.0 a 20.0 pH; -2.00 a 20.00 pH; -2.000 a 20.000 pH | |
| Resolución del pH | 0.1; 0.01; 0.001 pH | |
| Exactitud de pH (@25°C/77°F) | ±0.001 pH | |
| Calibración del pH | Hasta cinco puntos de calibración, 8 soluciones estándar y 5 soluciones personalizadas | |
| Intervalo de mV | -2000.0 a 2000.0 mV | |
| Resolución de mV | 0.1 mV | |
| Exactitud de mV (@25°C/77°F) | ±0.1 mV | |
| Calibración de mV | Un punto de offset | |
| Intervalo ISE | 1×10-6 a 9.99×1010 | |
| Resolución ISE | 1;0.1;0.01 | |
| Exactitud ISE | ±0.5% monovalente; ±1% divalente | |
| Calibración ISE | Hasta 5 puntos de calibración, siente soluciones estándar y 5 estándares definidos por el usuario | |
| Intervalo de temperatura | -5.0 a 105.0°C; 23.0 a 221.0°F; 268.2 a 378.2K | |
| Resolución de temperatura | 0.1°C; 0.1°F; 0.1K | |
| Exactitud de temperatura (@25°C/77°F) | ±0.1°C; ±0.2°F; ±0.1K; sin incluir el error de la sonda | |
| Compensación de temperatura | Manual (MTC) o automático (ATC) | |
| Agitador programado | Tipo propela, 200 a 2500 rpm, resolución 100 rpm | |
| Pantalla | 5.7” (320×240 pixeles) LCD a color con luz de fondo | |
| Tamaños de bureta | 5, 10, 25 y 50 mL | |
| Resolución de la bureta | 1/40000 | |
| Resolución de la pantalla | 0.001 mL | |
| Exactitud de la dosificación | ±0.1% del volumen total de la bureta | |
| Métodos | Hasta 100 métodos (estándar y definidos por el usuario) | |
| Registro de información | Hasta 100 tituladores y reportes de pH/mV/ISE | |
| Detección automática de la bureta | Se reconoce automáticamente el volumen de la bureta cuando se inserta a la unidad | |
| Flujo | Seleccionable por el usuario desde 0.1 mL/min hasta 2 veces el volumen de la bureta por minuto | |
| Determinación del punto final | Punto de equivalencia (primera o segunda derivada) o valor fijo de pH/mV | |
| Titulaciones potenciométricas | Ácido/base (modo pH o mV), redox, precipitación, complejométricas, no acuosas, de ion selectivo, argentométricas | |
| Unidades de medición | Expresión de las unidades de concentración especificadas por el usuario para adaptarse a los requerimientos específicos de los cálculos | |
| Gráficos en tiempo real y almacenados | Curva de titulación de mV-volumen o pH-volumen, curva de primera derivada o segunda derivada; modo pH, modo mV o modo ISE: pH/mV/concentración contra tiempo | |
| Conexión USB | Compatibilidad de dispositivo USB para transferencia de métodos y reportes | |
| Periféricos | Conexiones para teclado de PC externo, impresora, conexión para PC, balanza analítica y USB | |
| Conformidad GLP | Capacidad de almacenamiento de la información del equipo e impresión | |
| Idiomas | Inglés, portugués, español, alemán | |
| Condiciones de operación | 10 a 40°C (50 a 104°F), HR hasta 95% | |
| Alimentación eléctrica | 100-240 VCA; modelos “-01”, conexión US (tipo A); modelos “-02”, conexión europea (tipo C) | |
| Dimensiones | 315 x 205 x 375 mm (12.4 x 8.1 x 14.8”) | |
| Peso | Aprox. 4.3 kg (9.5 lbs) con una bomba, agitador y electrodos | |
| Información para ordenar | Cada titulador potenciométrico HI932 se suministra con: ensamble de la bomba, ensamble de la bureta, soporte para electrodos, agitador, tornillos de sujeción para bomba y bureta, se | |